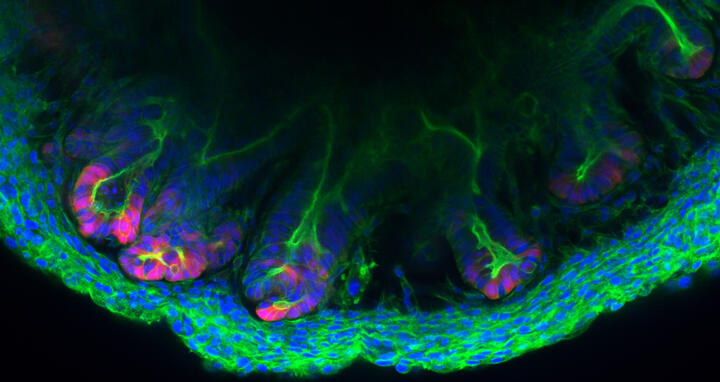
Darmgewebe aus dem Labor
Die innere Wand des Dickdarms ist alles andere als eben. Um die Oberfläche zu vergrößern, wechseln sich hohe Berge, Haustren genannt, und tiefe Täler, die Krypten, wie in einem Gebirge ab. Dabei folgen die unterschiedlichen Zellen, aus denen die Berge und Täler bestehen, einer strengen Architektur. In den Krypten beispielsweise sitzen ganz unten die Stammzellen, die sich teilen und differenzieren – sich also zum Beispiel zu Schleim produzierenden oder Wasser und Nahrung resorbierenden Zellen weiterentwickeln. Eingebettet sind diese Epithelzellen in das Stroma, ein zellreiches Bindegewebe, das von feinsten Blutgefäßen durchzogen ist. „Uns ist es gelungen, die Krypten außerhalb des Körpers in einer Präzision nachzubilden, die bislang unmöglich war“, sagt Professor Michael Sigal, Leiter der Arbeitsgruppe „Gastrointestinale Barriere, Regeneration und Karzinogenese“ am Berliner Institut für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB).
Fast wie im lebenden Organismus
Zusammen mit Forschenden der Charité – Universitätsmedizin Berlin, wo Sigal selbst auch Professor und Oberarzt in der Gastroenterologie ist, haben er und sein Team in der Kulturschale winzige Gebilde geschaffen, die sie Assembloide nennen und die sowohl Epithel- als auch Stromazellen enthalten. „Die Zellen organisieren sich selbst und nehmen nahezu die gleiche dreidimensionale Struktur an, wie sie es im lebenden Organismus tun“, erklärt Sigal. Veröffentlicht ist die gemeinsame Berliner Arbeit im Fachblatt „Nature Communications“.
Ein Darm-Assembloid aus der AG Sigal.
„Wir konnten in unseren Assembloiden verfolgen, wie die unterschiedlichen Zelltypen miteinander kommunizieren und ihre Funktionen gegenseitig aufrechterhalten“, berichtet der Erstautor der Studie, Dr. Manqiang Lin, aus Sigals Team. „Die Stromazellen produzieren zum Beispiel Wachstumsfaktoren, die die Teilung und Differenzierung der Stammzellen ganz unten in der Krypte beeinflussen.“ Als die wichtigsten Informationslieferanten haben die Forschenden eine Gruppe von Wachstumsfaktoren namens BMP (Bone Morphogenetic Proteins, auf Deutsch knochenmorphogenetische Proteine) ausgemacht. Es ist bekannt, dass sie nicht nur an der Entwicklung des Bewegungsapparates beteiligt sind, sondern auch dazu beitragen, dass der Gewebeauf- und -abbau im Gleichgewicht bleibt.
Darmkrankheiten besser verstehen
„Die BMP bewirken in den Assembloiden, dass die Stammzellen des Epithels beginnen, sich zu differenzieren“, sagt Lin. „Anschließend produzieren diese Zellen selbst BMP – sie wiederum führen dazu, dass die Stromazellen Faktoren bilden, die die Differenzierung weiter fördern.“ Verwendeten die Forschenden für ihre Experimente Epithel- oder Stromazellen, die keine funktionierenden Andockstellen für BMP besaßen, konnten sie mit ihnen keine künstlichen Krypten nachbauen.
In der jetzt publizierten Studie haben Sigal und sein Team Mäusezellen verwendet. „Wir haben die gleichen Experimente aber auch schon mit menschlichen Zellen gemacht und ähnlich gute Ergebnisse erhalten“, berichtet Sigal. Er möchte die im Labor erstellten Krypten nicht nur nutzen, um besser zu verstehen, wie sich das Darmgewebe entwickelt und organisiert. „Wenn wir Zellen von Patientinnen und Patienten verwenden, um die Assembloide zu züchten, könnte das helfen, die Entstehung von Darmkrankheiten wie Colitis ulcerosa oder Darmkrebs noch besser zu verstehen und modernere Therapieansätze zu entwickeln“, sagt der Forscher. „Zudem können wir unsere Modelle nutzen, um neue Medikamente an ihnen testen, und so auch dazu beitragen, Tierversuche zu reduzieren.“
Text: Anke Brodmerkel
Weiterführende Informationen
Literatur
Manqiang Lin et al. (2023): „Establishment of gastrointestinal assembloids to study the interplay between epithelial crypts and their mesenchymal niche“. Nature Communication, DOI: 10.1038/s41467-023-38780-3